细胞焦亡是肿瘤免疫治疗的新风向标,其特征是肿瘤细胞在药物的作用下,呈现跨膜孔、细胞肿胀和溶解等现象,导致炎症因子和细胞内容物的释放,引发强烈炎症,激活抗肿瘤免疫原性,抑制肿瘤生长和转移。目前研究发现,化疗药物等可诱导肿瘤细胞焦亡,然而,其导致的非特异性细胞焦亡,对正常细胞也有伤害,存在严重的生物安全性问题。因此,在保护正常细胞的同时触发特异性肿瘤细胞焦亡仍然是一个重大的挑战。
近日,中国科学院理化技术研究所汪鹏飞研究员、葛介超研究员和西北工业大学贾庆岩副教授通过Cu2+与5,10,15,20-四(对苯甲酸)菌绿素(TBB)配位,设计了一种全新的肿瘤细胞焦亡诱导剂--铜-菌绿素纳米片(Cu-TBB)。Cu-TBB在正常细胞和组织中处于“关闭”状态(失活)。然而,在GSH水平高的肿瘤细胞和肿瘤组织中,由于Cu-TBB的分解,它被激活到“开启”状态,导致Cu+和TBB的特异性释放。随后,释放的Cu+可以催化内源性O2转化为![]() 。同时,形成的
。同时,形成的![]() 可以进一步进行超氧化物歧化酶(SOD)歧化和Haber-Weiss反应,产生可循环使用的O2和剧毒·OH。除此之外,“开启”的TBB可以在750nm的光照射下产生
可以进一步进行超氧化物歧化酶(SOD)歧化和Haber-Weiss反应,产生可循环使用的O2和剧毒·OH。除此之外,“开启”的TBB可以在750nm的光照射下产生![]() 和1O2。上述产生的大量活性氧物种可以激活gasdermin-D(GSDMD)介导的细胞焦亡,并促进炎性细胞因子(IL-1β和IL-18)的释放,从而增强树突状细胞(DC)的成熟和T淋巴细胞的启动,从而同时消除了原发性肿瘤并抑制了远处肿瘤的生长和转移。总之, Cu-TBB纳米片被证明可以在细胞和活体层面引发特异性细胞焦亡,从而增强肿瘤免疫原性和抗肿瘤功效,同时最大限度地减少全身副作用。
和1O2。上述产生的大量活性氧物种可以激活gasdermin-D(GSDMD)介导的细胞焦亡,并促进炎性细胞因子(IL-1β和IL-18)的释放,从而增强树突状细胞(DC)的成熟和T淋巴细胞的启动,从而同时消除了原发性肿瘤并抑制了远处肿瘤的生长和转移。总之, Cu-TBB纳米片被证明可以在细胞和活体层面引发特异性细胞焦亡,从而增强肿瘤免疫原性和抗肿瘤功效,同时最大限度地减少全身副作用。
该工作在肿瘤细胞特异性焦亡纳米药物的合理设计和精准靶向递送等方面开辟了新思路,相关研究结果以Copper-Bacteriochlorin Nanosheet as A Specific Pyroptosis Inducer for Robust Tumor Immunotherapy为题发表在Advanced Materials上。理化所张云秀博士为论文第一作者,汪鹏飞研究员、葛介超研究员和西工大贾庆岩副教授为共同通讯作者。该研究工作得到了国家自然科学基金、中国科学院和理化所的大力支持。
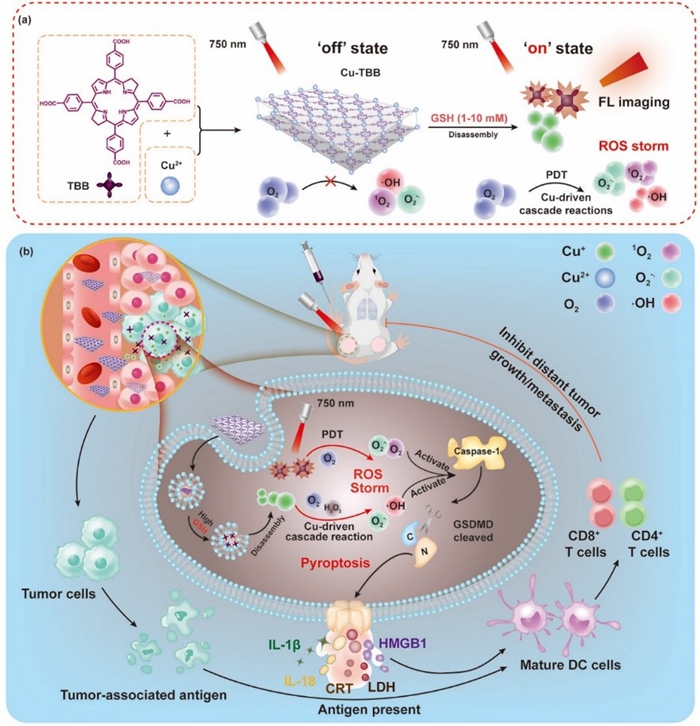
Cu-TBB纳米片的制备(a)和诱导细胞焦亡激活免疫原性机制(b)示意图
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202305073
新闻中心