晚期癌症患者常因远端转移问题,失去根治机会。近年来,随着局部消融手术在肿瘤临床的广泛应用,极少部分患者在局部消融手术后出现远端肿瘤(非消融灶)的缩小,这就是所谓的“远端效应”。这可以认为是一种免疫效应,但总体上其发生率极低。如何大幅提升远端效应发生的概率,从而增加癌症患者生存期,是一个迫切需要解决的临床挑战。
如何解决这一问题?自体肿瘤原位疫苗可能是一种新思路。它能准确地将病人自身的肿瘤特异性抗原和免疫佐剂传递给抗原提呈细胞(主要是树突状细胞,DCs),从而诱导抗原特异性免疫反应,引发远端效应,达到“牵一发而动全身”的治疗目的。近十多年来,关于治疗性癌症疫苗(TCVs)的研究已经经历了一次复苏。与保护易感人群免受某些病毒病因威胁的传统预防性癌症疫苗(如乙肝病毒(HBV)和人乳头瘤病毒(HPV))不同,治疗性癌症疫苗作为主动免疫疗法,旨在刺激宿主适应性免疫以诱导恶性肿瘤的消退,减少转移性肿瘤和根除残留肿瘤。尽管研究人员付出了大量努力,目前只有一种基于自体树突状细胞的治疗性癌症疫苗,sipuleucel-T,获得美国食品和药物管理局批准,但是其临床疗效并不令人满意。通过传统方法开发的TCVs主要受限于几个主要的障碍,如:(I)肿瘤的异质性,难以筛选出最佳的免疫优势肿瘤抗原。(II)抗原利用效率低下,不足以引起强大的免疫反应,以及(III)免疫抑制性肿瘤微环境(TME),即肿瘤细胞通过失调、失活和劫持宿主免疫系统来逃避免疫监视。为了应对这些挑战,将自体肿瘤抗原转化为原位癌症疫苗(ISCVs)已成为一种有前景的策略,为个性化的TCVs提供了替代方法。针对转移性肿瘤的ISCVs所需要的基本原则包括:产生大量高质量的抗原,将抗原和免疫佐剂时空协同地递送给抗原呈递细胞(主要是DCs),激活细胞毒性T淋巴细胞,浸润到TME从而诱导强烈和持续的免疫反应。因此,可以通过一种兼具自体抗原吸附性、刺激释放载体功能和免疫佐剂能力的多功能纳米平台,将局部冷/热疗法和免疫疗法结合起来,为开发个性化的ISCVs提供广阔前景。
1. 光热诱导纳米液态金属肿瘤疫苗
近期,中国科学院理化技术研究所液态金属与低温生物医学研究中心在国际期刊ACS Nano以封面论文形式发表了题为“Liquid Metal Nanoplatform Based Autologous Cancer Vaccines”的研究文章,提出了采用免疫响应型液态金属纳米平台构建光诱导肿瘤纳米疫苗的策略。论文的第一作者是中国科学院理化技术研究所博士生汪达伟与北京中医药大学博士生于中阳,通讯作者是中国科学院理化技术研究所饶伟研究员及刘静研究员和北京中医药大学周天副教授。
镓基液态金属纳米颗粒具有良好的光热/光动力效应、柔性形变特性。更为独特的是,前期实验验证镓基液态金属纳米颗粒具备氧化层本征的抗原吸附特性以及潜在的免疫佐剂性能,受这些有益特性的启发,液态金属与低温生物医学研究中心饶伟研究员及刘静研究员团队提出了采用免疫响应型液态金属纳米平台构建光诱导肿瘤纳米疫苗的策略。通过表征实验和体外细胞实验证明该免疫响应型液态金属纳米平台兼具肿瘤治疗性疫苗所需的基本特性:1)在近红外激光刺激下有效地破坏原位肿瘤以生成大量具有免疫原性的自体肿瘤抗原;2)氧化镓能够有效捕获肿瘤抗原并递送至树突状细胞(DCs),提高抗原的利用率;3)镓显示出类似铝的免疫佐剂能力,能够促进抗原呈递细胞的成熟和激活。接着,在转移性乳腺癌模型中验证了基于免疫响应型液态金属纳米平台的光诱导肿瘤纳米疫苗的肿瘤特异性免疫响应、肿瘤预防效果以及肿瘤抑制效果。抗肿瘤免疫机制研究表明,该联合治疗方案成功唤醒了具有肿瘤特异性和长期免疫记忆效应的适应性免疫响应,能够通过调节肿瘤微环境和扩增细胞毒性T淋巴细胞实现重建肿瘤杀伤性免疫反馈回路(图1)。总之,该研究验证了基于免疫响应型液态金属纳米平台构建光诱导肿瘤纳米疫苗的潜力,将推动免疫响应型液态金属生物材料的前沿探索。
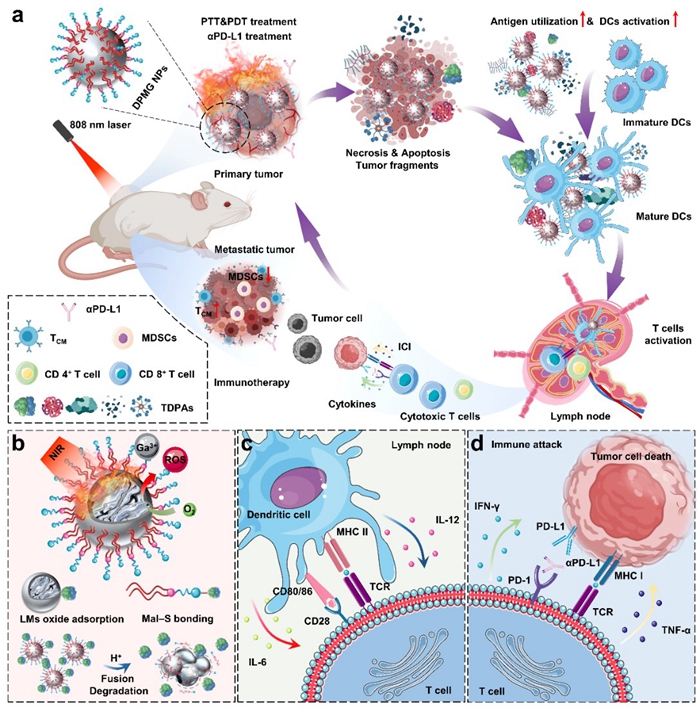
图1 基于免疫响应型液态金属纳米平台的光诱导肿瘤纳米疫苗的潜在免疫机制。
注:(a)杀伤性免疫反馈的示意图。(b)液态金属纳米材料的光热/光动力,抗原捕获和微酸环境降解等特性的示意图。(c)成熟的DCs处理和交叉呈递抗原,促进T细胞的成熟和激活。(d)激活的T细胞识别肿瘤细胞,并伴随着细胞因子的分泌和免疫检查点的阻断,从而实现免疫攻击。
2. 冷冻诱导纳米中药肿瘤疫苗
中医学自《黄帝内经》始,即有“营在脉中,卫在脉外,营周不休……阴阳相贯,如环无端”的理论。历代认为,卫气司卫外功能,属于阳气的一种,生于水谷,行于脉外,具有温养、护卫、防御等重要功能。在中医肿瘤临床,扶正为主、提升卫气功能为各派医家认同。如何更加精准地实现扶正、实现提升护卫功能,一直为临床研究者探索。
中国科学院理化技术研究所液态金属与低温生物医学研究中心与北京中医药大学东方医院联合团队长期从事冷冻消融治疗肿瘤的基础及临床研究,双方曾共同开展了国内外首台冷热复合治疗系统的临床实验,并基于“寒热理论”开展了肺癌冷消融生物热物理机制探索。在最新研究中,该联合团队总结了数十年冷冻消融临床研究,为促进和强化冷冻消融的“远端效应”,同时结合中药免疫佐剂特点,以中医肿瘤临床最为常用的补气药黄芪为切入点,设计了高效抓取冷冻消融后肿瘤原位碎片的纳米中药疫苗,提出了黄芪多糖纳米肿瘤疫苗与冷冻消融手术联合应用的癌症治疗模式。在这项工作中,该团队设计的黄芪多糖纳米肿瘤疫苗,通过表面修饰后可吸附冷冻消融后的肿瘤碎片(抗原),靶向呈递至淋巴结中,在树突状细胞内部通过pH响应释放肿瘤抗原及黄芪多糖以激活抗原特异性的全身免疫治疗(图2)。该方法除对局部肿瘤进行有效杀伤外,同时具有激活全身的肿瘤抗原特异性免疫、抑制远端及转移瘤体生长的重要作用。
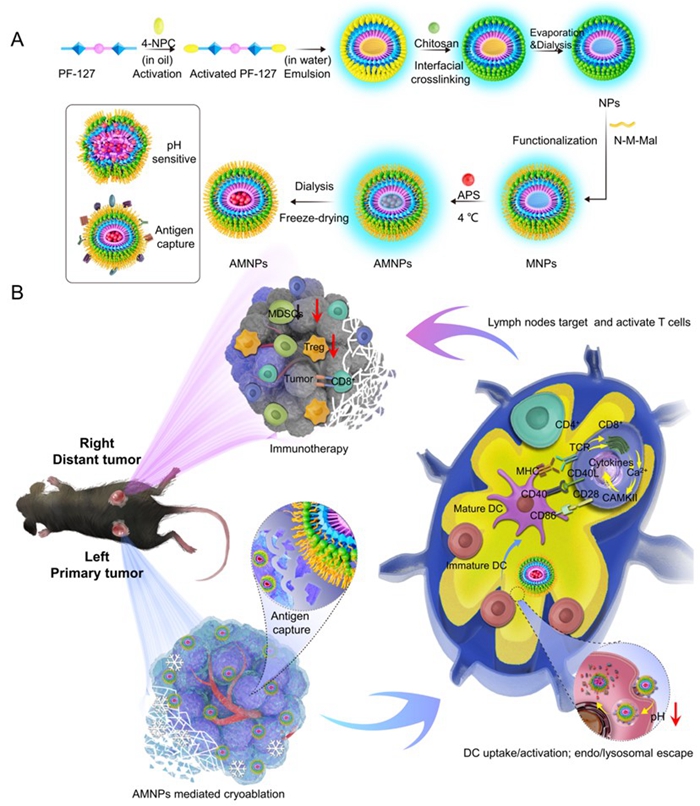
图2 基于免纳米中药平台的冷冻诱导肿瘤纳米疫苗的潜在免疫机制
注:(A)冷冻诱导纳米中药疫苗合成过程的示意图。(B)联合纳米介导的原位疫苗效果示意图:原位肿瘤进行冷冻消融产生的抗原碎片被纳米中药疫苗吸附,进而靶向淋巴结,溶酶体逃逸后熟化DC细胞,激活T细胞。TCR:T细胞受体;MHC:主要组织相容性复合体。
研究者通过对粒径的控制,可有效地阻止纳米颗粒被血液代谢,更多AMNPs进入淋巴管回流进而进入瘤周淋巴结。该纳米材料具有卓越的肿瘤抗原吸附能力,可被DC细胞吞噬,并具有溶酶体逃逸功能,可有效地促进DC细胞成熟,并具有很好的生物安全性。研究者通过小动物活体成像技术,充分证实了AMNPs在活体内的代谢及淋巴结靶向功能,以及冷冻消融可以延缓AMNPs在肿瘤区域的代谢,可望增加肿瘤抗原的吸附。在双侧Lewis肺癌肿瘤模型中,AMNPs介导的冷冻消融可以明显地使原发肿瘤消退(肿瘤生长抑制率为100%,复发率为0%(30天)和16.67%(60天)),抑制未经治疗的远端肿瘤生长(与生理盐水组相比减少约3.84倍),并最终提高长期生存率(83.33 %)。研究者还利用流式细胞术,充分证实了该联合疗法可增加消融病灶与远端病灶中CD8+T及MHC-II+DC细胞的浸润,降低肿瘤微环境中免疫抑制细胞的数量(MDSCs,Tregs),并通过转录组学检测初步探讨了联合治疗的潜在作用机制。最后,研究者利用OVA特异性四聚体,在LLC-OVA双瘤小鼠模型中检验了肿瘤抗原特异性免疫的激活情况,结果提示在脾脏和淋巴组织中,肿瘤抗原特异性CD8+T细胞及MHC-I+DC的数量均显著增加。
综上,受中医“寒热理论”及“卫行脉外”理论启发,研究团队开发了一种可靶向淋巴结的黄芪多糖纳米肿瘤原位疫苗,在与冷冻消融联合应用的情况下,可实现肿瘤抗原特异性免疫激活,有效抑制了远端及转移瘤体生长,重塑了远端肿瘤区域的免疫微环境。该工作首次提出了纳米肿瘤疫苗与冷冻消融联合的应用策略,创新性制备了与冷冻消融适配的黄芪多糖纳米肿瘤疫苗,具有重大临床应用前景。
关于黄芪多糖纳米肿瘤疫苗联合冷冻消融治疗癌症的研究工作以“Autologous Cancer Cryoablation Mediated Nanovaccine Augments Systematic Immunotherapy”为题,被选为Materials Horizons封面故事。北京中医药大学研究生院于中阳博士和中国科学院理化技术研究所汪达伟博士为本论文共同第一作者,中科院理化技术研究所饶伟研究员、北京中医药大学东方医院周天副教授及胡凯文教授为本论文共同通讯作者。
上述两项研究均得到了国家自然科学基金项目课题(No.51890893)和国家重点研发计划项目(No. 2018YFC1705106)的资助。
原文链接:
新闻中心