传统光动力疗法依赖外部光源激发光敏剂产生活性氧物种杀伤病原体,但可见光和近红外光的组织穿透深度不足2cm,难以作用于深部感染病灶。利用化学发光激发的光动力疗法虽可避免外部光源依赖,但其治疗效果受限于供体-受体间能量转移效率低、化学发光强度弱等问题。
近期,中国科学院理化技术研究所光电信息材料与器件研究中心在深部细菌感染治疗领域取得新进展。研究团队开发了超声触发的I型超分子光敏剂RDL@RM NPs,通过超声触发与分子内化学发光共振能量转移协同驱动的原位循环光动力疗法,克服了传统光动力疗法组织穿透浅、疗效受限的挑战,为肺炎等深部感染的精准治疗提供了新思路。
研究团队首先以Ru(II)配合物为光敏核心,通过π共轭扩展引入竹红菌素衍生物,构建出高效I型光敏剂Ru-DMHC。随后通过配位共价键,将其与超氧阴离子自由基响应型化学发光供体BLP以2+2自组装策略整合为超分子光敏剂RDL。两组分间展现出优异的光谱重叠。该设计策略有效缩短了供受体之间的距离,实现了高达97%的化学发光共振能量转移效率。
在超声激活下,RDL可高效产生羟基自由基与超氧阴离子自由基;同时,RDL自身产生的超氧阴离子自由基与炎症部位过表达的内源性超氧阴离子自由基协同作用,触发化学发光配体发射强荧光,进而激活Ru(II)基光敏剂受体产生大量羟基自由基与超氧阴离子自由基。在此过程中,超氧阴离子自由基可通过化学发光共振能量转移介导的光动力循环转化为生物学中活性最强、毒性最高的活性氧——羟基自由基。此外,超声诱导的空化效应能够显著增强化学发光强度,最终实现超声触发与分子内化学发光共振能量转移共同驱动的原位循环化学发光介导的光动力治疗。
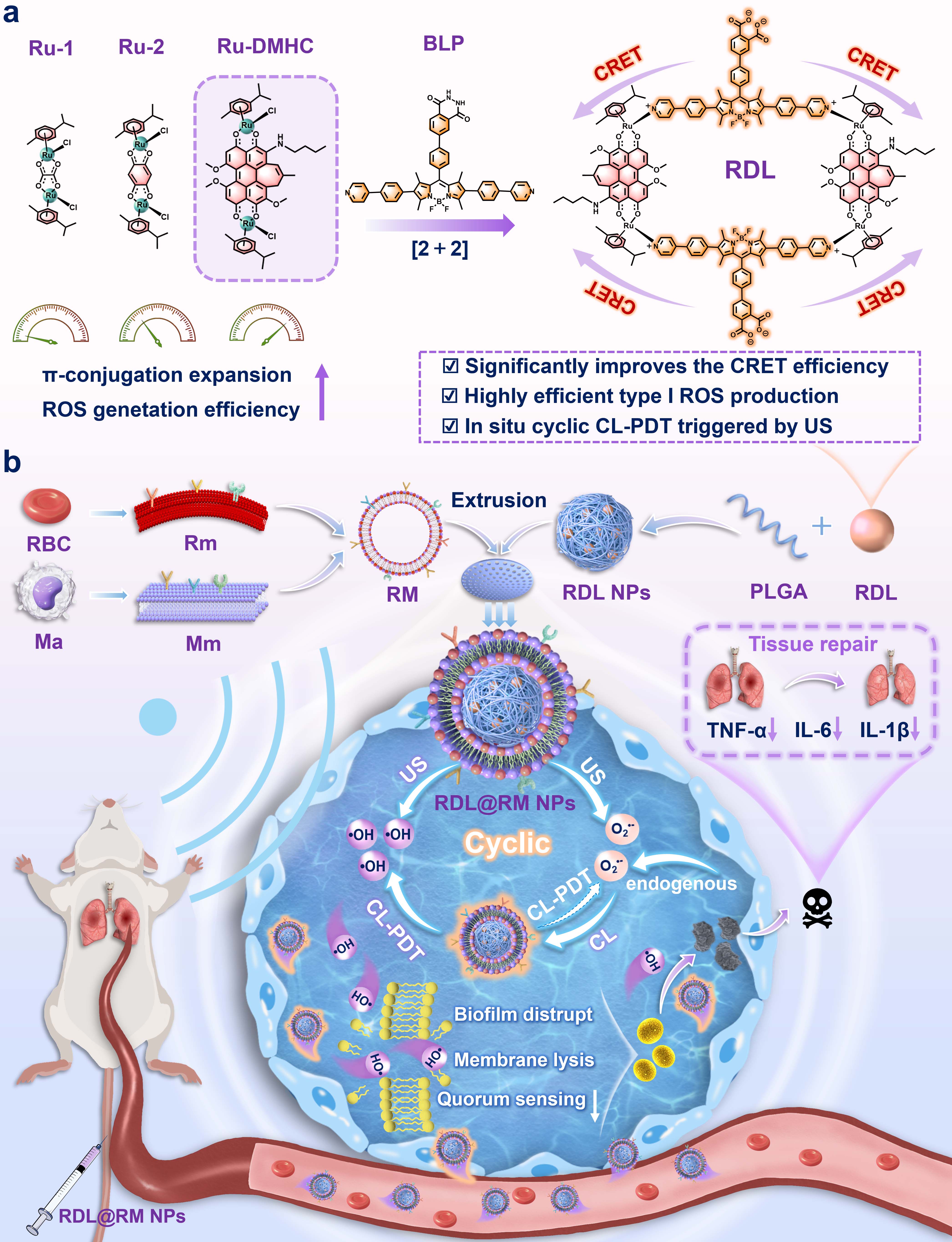
图1 (a)RDL设计的示意图;(b)RDL@RM NPs的制备及对急性耐甲氧西林金黄色葡萄球菌肺炎的治疗示意图
为提升RDL的靶向效率,研究团队通过杂化细胞膜外壳包覆策略构建了仿生靶向纳米颗粒RDL@RM NPs,可实现对炎症部位的靶向和富集,进而通过化学发光介导的光动力治疗有效根除深部缺氧组织中的病原体。
本研究为超声触发的基于化学发光超分子光敏剂的开发及其在深部细菌感染治疗中的应用提供了有力支撑。相关研究成果发表在Journal of the American Chemical Society上,论文第一作者为2021级博士研究生李红雪,通讯作者为汪鹏飞研究员和郑秀丽副研究员。该工作得到国家重点研发计划、国家自然科学基金及理化所所长基金的支持。
新闻中心